Транспорт лекарств в живых клетках
Одной из наиболее трудных стадий на пути к эффективности лекарственного средства является преодоление цитоплазматической мембраны клетки. Для того, чтобы попасть к месту оказания эффекта, большинство молекул лекарственных средств должно преодолеть этот барьер. Попав внутрь клетки, они затем могут - например, взаимодействуя с белком - целенаправленно блокировать или активировать путь передачи сигнала.
Цитоплазматическая мембрана играет роль защитного вала, и питательные вещества поступают из окружающей среды внутрь клетки преимущественно с помощью активного транспорта через специализированные пути. Большинство лекарственных средств, однако, не может попасть в клетку посредством этих механизмов.
В конце 1980—х впервые было показано, что внесенный извне белок ВИЧ поступает внутрь клеток, в результате чего происходит изменение внутриклеточных сигнальных путей. Вскоре за этим последовало открытие, что факторы транскрипции дрозофилы обладают похожими свойствами. Выяснилось, что короткие пептидные последовательности могут обладать способностью проникать через мембрану, и вскоре возникло понятие проникающих (в клетку) пептидов (cellpenetratingpeptides, CPPs). Проникающие пептиды обладают поразительным свойством: они могут проникать во все виды клеток и при этом транспортировать внутрь клетки связанные с ними молекулы. Для того, чтобы эффективнее использовать возможности транспорта с помощью CPPs, с момента их открытия ведутся интенсивные поиски механизмов, лежащих в основе этой способности.
Внимание нашей исследовательской группы сосредоточено на двух задачах: во-первых, мы стремимся выяснить механизмы проникновения через цитоплазматическую мембрану, во-вторых, мы используем проникающие пептиды для визуализации живых клеток и нацеленного вмешательства в пути передачи сигнала, т. е, для манипуляции физиологическими процессами в клетке [1]. Несомненно, что проникающие пептиды транспортируют вещества в клетку через пути, до сих пор не известные. Поэтому профессор Кардозо совместно со своей группой‚ включающей биологов,` биохимиков, химиков, физиков и врачей, использует для изучения принципа функционирования проникающих пептидов интредисциплинарный подход.
Что представляют собой проникающие в клетку пептиды?
Благодаря своей способности проводить внутрь клетки действующие вещества, такие, как лекарства, проникающие пептиды также получили название «троянских пептидов». Они представляют собой короткие последовательности (<30 аминокислот), состоящие преимущественно из остатков аргинина и лизина, и поэтому несут сильный положительный заряд.
Вокруг механизма проникновения этих пептидов в клетку и их способности транспортировать другие молекулы по-прежнему ведутся противоречивые дискуссии, и существует вероятность того, что таких механизмов несколько. Группе проф. Кардозо удалось показать, что для попадания внутрь клетки проникающие пептиды не затрачивают энергию метаболизма [2]. Это наглядно свидетельствует о том, что путь поступления этих пептидов в клетку отличается от пути активного транспорта питательных веществ (эндоцитоза). Если при эндоцитозе транспортируемые вещества попадают в клетку заключенными в липидный бислой, то после переноса через плазмалемму с помощью проникающих белков они сразу становятся биодоступны (Рис. 1).
Как показал д—р Эрос, используя для этого чувствительные методы, регистрирующие потоки ионов через мембрану, проникающие пептиды действительно непосредственно переходят через мембрану внутрь клетки. При этом CPPs образуют крошечные, очень короткоживущие отверстия и пересекают плазматическую мембрану через этот «тунель». Эти временные отверстия лежат в основе механизма попадания внутрь клетки и транспорта лекарств и биомаркеров [З, 4] (Рис. 2).
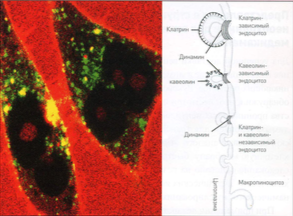
Рис. 1 Поглощение проникающего пептида ТАТ не зависит от эндоцитоза.
Пептид ТАТ (красный цвет] пересекает клеточную мембрану и распределяется в цитоплазме живой клетки, а также скапливается в ядрышках внутри клеточного ядра. Эндоцитозные пузырьки визуализированы с помощью захвата трансферрина (зеленый цвет). На схеме кратко представлены возможные пути проникновения внутрь клетки путем эндоцитоза.
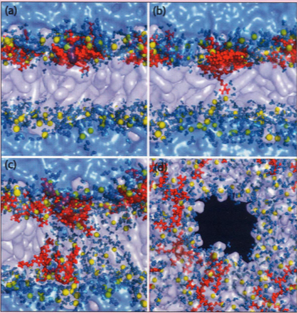
Рис. 2 Молекулярно-динамическая модель связывания и транслокации проникающего пептида ТАТ.
Фосфолипиды мембраны имеют прозрачную белую поверхность, атомы фосфора представлены в виде желтых шаров, пептид ТАТ представлен красным цветом. На расстоянии менее 3.5 ангстрём молекулы воды выглядят как синие прозрачные поверхности, (а) Моментальное изображение после связывания пептида ТАТ с поверхностью двухслойной фосфолипидной мембраны. (Ь) Некоторые остатки аргинина пептида ТАТ достигают внутреннего пространства клетки, (c-d) Прямым следствием этого события является образование временной поры, через которую пептид может проникнуть внутрь клетки.
Представление о структуре и функции CPPs, необходимое для оптимизации транспорта медикаментов
Для успешной доставки веществ внутрь клетки решающее значение имеет понимание взаимоотношения структуры и функции проникающих пептидов. Руководствуясь этой задачей, д-р Тюннеманн обнаружил, что, несмотря на вытянутую конформацию большинства проникающих пептидов, такая структура не является необходимым условием для транслокации через плазмалемму. Фактически, кольцевые аналоги этих пептидов переносят вещества через клеточную мембрану быстрее и в целом эффективнее [5]. Это исследование основано на результатах микроскопии живых клеток, химических и физических исследований, а также молекулярно-динамического моделирования (Рис. 3).
При применении лекарственного препарата первостепенная задача состоит в том, чтобы он достиг как можно большего числа больных клеток. В случае раковых клеток это имеет решающее значение. При нормальных условиях эффективность транслокации проникающих пептидов различается в зависимости от типа клеток. Понимание возможных способов повышения эффективности прохождения через цитоплазматическую мембрану - будь то с помощью недавно опубликованного метода вариации пептидного остова или с помощью других, еще не известных факторов, во много раз повышающих эффективность известных проникающих пептидов - является важным шагом. Таким образом можно добиться, чтобы терапия достигла всей популяции раковых клеток и дала успешные результаты благодаря введению вещества в клетку.
Помимо этого мы работаем над повышением биодоступности веществ, поступающих в клетку с помощью проникающих пептидов. Для этого мы создаем такие проникающие пептиды, которые после успешного проникновения через мембрану высвобождают транспортируемое вещество, позволяя ему быть полностью активным. Использование комбинации этих методов для оптимизации проникающего пептида в качестве носителя является основным условием для разработки новых веществ-переносчиков, входящих в состав кремов и прочих наносимых на кожу средств.
Пептиды в качестве лекарств и биомаркеров
В настоящее время в центре нашего внимания - дальнейшая оптимизация и специфическое нацеливание пептида для целенаправленной визуализации клеточных процессов и целенаправленного вмешательства в случае болезненных изменений. Использование коротких пептидов, изменяющих контактную поверхность белков и, таким образом, их способность к взаимодействию с белками-партнерами, представляется привлекательным по следующим причинам: С одной стороны, можно создавать высококачественные пептиды, не содержащие создающих проблем примесей, с другой стороны, они высокоспецифичны и благодаря своей низкой токсичности являются альтернативой другим низкомолекулярным терапевтически эффективным веществам. При использовании in vitro и в экспериментах на животных они позволяют избежать генетических манипуляций и связанных с ними рисков. Успешные пептиды-кандидаты идентифицируют с помощью протеомики и интерактомики и, используя методы in-vitro и in-silico, придают им способность к ингибированию нужного взаимодействия, т. е. делают высокоаффинными. Затем транспорт с помощью проникающего компонента модифицируют с целью оптимизации доставки образовавшегося пептида слияния в нужное место, чтобы он мог проявить свое действие в специфическом для него клеточном компартменте.
После выбора идеального пептида исследуют успешные примеры прерывания пути передачи сигнала в живых клетках. Исследовательской группой проф. Кардозо в сотрудничестве с коллегами из Мюнхенского университета Людвига Максимилиана в течение нескольких лет было разработано множество методов для общих исследований белковых взаимодействий, клеточного цикла, повреждения и репарации ДНК - в живых клетках и в режиме реального времени. Эти методы исследования на живых клетках являются основной предпосылкой для понимания того, как и в каком количестве лекарственное вещество достигает своей цели, в каком промежутке времени возможно применение и какова длительность его действия. Таким образом, они необходимы для заключения о его пригодности в качестве медикамента (Рис. 4).
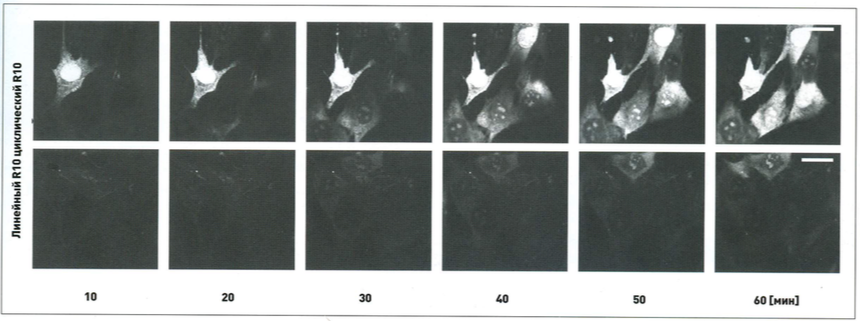
Рис. 3 Кадры из фильма, полученного с помощью конфокальной оптической микроскопии, для сравнения поглощения линейной и циклической формы проникающего пептида R10, состоящего из 10 последовательно соединенных остатков аргинина.
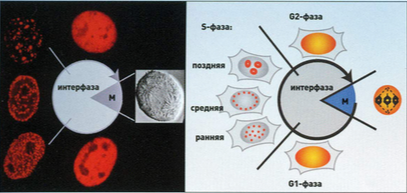
Рис.4 Наблюдение за ходом цикла в живой клетке в реальном времени с помощью флуоресцентной версии фактора репликации ДНК (здесь ядерный антиген пролиферирующих клеток).
Пептиды, болезни и прочее
Наше исследование охватывает большую область биологических процессов и методологических инструментов. Нас воодушевляет идея понимания клетки как строительного блока каждого организма на молекулярном уровне. Поэтому помимо изучения транспорта биомолекул с помощью проникающих пептидов группа проф. Кардозо занимается также взаимодействиями белок-белок и белок-ДНК, особенно в приложении к вопросам репликации, модификации и репарации ДНК, пролиферации и дифференцировки клеток, проводя исследования как in vitro, так и in vivo. Информация на эту тему, наши научные публикации, оптимизированные методы и протоколы, а также ссылки на образовательные ресурсы для начинающих и студентов содержатся на нашем сайте (www.cardoso-lab.org). Одна из страниц на этом сайте специально посвящена световой микроскопии, ее принципам и применению. Для высказывания мнений и обмена знаниями о проникающих пептидах (CPPS) д-р Эрсе создал динамический веб-сайт, позволяющий ученым и людям, интересующимся этой проблемой, загружать и обсуждать результаты исследований и обзорные статьи о проникающих пептидах. Кроме того, на этой страничке имеется база данных, в которой выложены последовательности СРР, патенты, статистика и прочее (www.cell-penetrating-peptides.com).
Эти междисциплинарные подходы, обучение студентов и научных работников и постоянное развитие новых теоретических и экспериментальных методов исследования являются важными предпосылками для успешного применения пептидов с целью направленного управления клеточными процессами и внедрения новых способов лечения.
Публикации
- Инновационные подходы к оптимизации белкового питания рыб
- Эффективность применения кормовой добавки "Абиотоник" высокопродуктивным коровам
- Как уменьшить период откорма бычков на 7 месяцев?!
- Абиопептид для лошадей
- Абиопептид в козоводстве
- Продуктивность и двенадцатикратная прибыльность
- Эффективность ферропептида для профилактики железодефицитной анемии поросят
- О развитии производства противоанемических препаратов в России
- «Абиопептид» в кормлении бройлеров
- Новая жизнь Суиферровита – Суиферровит®-А